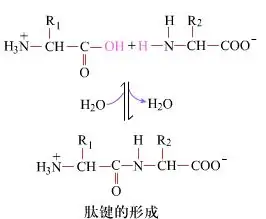
La suprafață, formarea legăturilor peptidice, dipptide, este un proces chimic simplu. Aceasta înseamnă că cele două componente de aminoacizi sunt legate de o legătură peptidă, o legătură amide, în timp ce sunt deshidratate.
Formarea legăturii peptidice este activarea unui aminoacid în condiții ușoare de reacție. (A) Furnizarea carboxilului, al doilea aminoacid (B) Nucleofil activat carboxil, apoi formează dipeptida (A-B). „Dacă componenta carboxil (A) nu este protejată, formarea legăturii peptidice nu poate fi controlată.” Produsele secundare, cum ar fi peptidele liniare și ciclice, pot fi amestecate cu compuși țintă A-B. Prin urmare, toate grupurile funcționale care nu sunt implicate în formarea legăturilor peptidice trebuie protejate într -o manieră reversibilă temporar în timpul sintezei peptidelor.
Deci, sinteza peptidelor - formarea fiecărei legături peptidice - implică trei etape de agregare.
Primul pas este pregătirea unor aminoacizi care au nevoie de protecție, iar structura zwitterionică a aminoacizilor nu mai există.
A doua etapă este o reacție în două etape pentru a forma legături peptidice, în care grupa carboxil a aminoacizilor protejați N este activată mai întâi la intermediarul activ și apoi se formează legătura peptidă. Această reacție cuplată poate apărea fie ca reacție cu un pas, fie ca două reacții secvențiale.
Al treilea pas este îndepărtarea selectivă sau eliminarea completă a bazei de protecție. Deși toată îndepărtarea poate apărea numai după ce toate lanțurile peptidice au fost asamblate, este necesară și eliminarea selectivă a grupurilor de protecție pentru a continua sinteza peptidelor.
Deoarece 10 aminoacizi (Ser, Thr, Tyr, ASP, Glu, Lys, Arg, His, SEC și Cys) conțin grupuri funcționale ale lanțului lateral, care necesită o protecție selectivă, ceea ce face sinteza peptidelor mai complicată. Bazele de protecție temporare și semi-permise trebuie distinse din cauza cerințelor diferite pentru selectivitate. Grupurile de protecție temporară sunt utilizate în următoarea etapă pentru a reflecta protecția temporară a aminoacizilor sau a grupărilor funcționale carboxilice. Grupurile de protecție semipermanente sunt îndepărtate fără a interfera cu legături peptidice deja formate sau lanțuri laterale ale aminoacizilor, uneori în timpul sintezei.
„În mod ideal, activarea componentei carboxilice și formarea ulterioară a legăturilor peptidice (reacții de cuplare) ar trebui să fie rapidă, fără formare racemică sau de produs secundar, iar reactanții molari ar trebui să fie aplicate pentru a obține randamente mari.” Din păcate, niciuna dintre metodele de cuplare chimică nu satisface aceste cerințe, iar puține sunt potrivite pentru sinteza practică.
În timpul sintezei peptidelor, grupurile funcționale implicate în diferite reacții sunt de obicei legate de centrul manual, glicina fiind singura excepție și există un risc potențial de rotație.
Ultima etapă a ciclului de sinteză a peptidelor este eliminarea tuturor grupurilor de protecție. Îndepărtarea selectivă a grupurilor de protecție este importantă pentru extinderea lanțului peptidelor, pe lângă cerința pentru îndepărtarea completă a protecției în sinteza dipeptidelor. Strategiile sintetice ar trebui planificate cu atenție. În funcție de alegerea strategică, n poate elimina selectiv grupurile de protecție α-amino sau carboxil. Termenul „strategie” se referă la secvența reacțiilor de condensare a aminoacizilor individuali. În general, există o diferență între sinteza treptată și condensarea fragmentelor. Sinteza peptidelor (cunoscută și sub denumirea de „sinteză convențională”) are loc în soluție. În cele mai multe cazuri, prelungirea treptată a lanțului peptidic poate fi sintetizată numai prin utilizarea lanțului peptidic pentru a sintetiza fragmente mai scurte. Pentru a sintetiza peptide mai lungi, moleculele țintă trebuie segmentate în fragmente adecvate și au stabilit că pot minimiza gradul de diferențiere la capătul C. După ce fragmentele individuale sunt asamblate treptat, compusul țintă va fi unit. Strategia sintezei peptidelor include selecția celui mai bun și cel mai adecvat fragment de protecție, iar strategia de sinteză a peptidelor include selecția celei mai potrivite combinații de baze de protecție și cea mai bună metodă de conjugare a fragmentelor.
Timpul post: 2025-07-02