Peptidele sunt o clasă de compuși formați prin conectarea mai multor aminoacizi prin legături peptidice. Sunt omniprezente în organismele vii. Până în prezent, în organismele vii au fost găsite zeci de mii de peptide. Peptidele joacă un rol important în reglarea activităților funcționale ale diferitelor sisteme, organe, țesuturi și celule și în activitățile de viață și sunt adesea utilizate în analiza funcțională, cercetarea anticorpilor, dezvoltarea medicamentelor și alte domenii. Odată cu dezvoltarea tehnologiei biotehnologiei și a sintezei peptidelor, în clinică au fost dezvoltate din ce în ce mai multe medicamente peptidice.
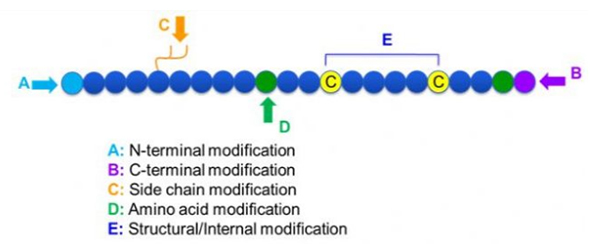
Există o mare varietate de modificări peptidice, care pot fi împărțite pur și simplu în modificarea postului și modificarea procesului (folosind modificarea aminoacizilor derivați) și modificarea N-terminal, modificarea C-terminal, modificarea lanțului lateral, modificarea aminoacizilor, modificarea scheletului etc., în funcție de locul de modificare (figura 1). Ca mijloc important pentru modificarea structurii principale a lanțului sau a grupurilor laterale ale lanțurilor de lanțuri peptidice, modificarea peptidelor poate modifica eficient proprietățile fizice și chimice ale compușilor peptidici, să crească solubilitatea apei, să prelungească timpul de acțiune în vivo, să își schimbe distribuția biologică, să elimine imunogenitatea, să reducă efectele secundare toxice, etc. În această lucrare, mai multe strategii de modificare a peptidelor majore și caracteristicile lor sunt introduse.
1. Ciclizare
Peptidele ciclice au multe aplicații în biomedicină, iar multe peptide naturale cu activitate biologică sunt peptide ciclice. Deoarece peptidele ciclice tind să fie mai rigide decât peptidele liniare, ele sunt extrem de rezistente la sistemul digestiv, pot supraviețui în tractul digestiv și pot prezenta o afinitate mai puternică pentru receptorii țintă. Ciclizarea este cea mai directă modalitate de a sintetiza peptidele ciclice, în special pentru peptidele cu schelet structural mare. Conform modului de ciclizare, acesta poate fi împărțit în tipul lanțului lateral al lanțului, tipul lanțului lateral, tipul terminal - tip terminal (tip de la capăt la capăt).
(1) Sidechain-to-latechain
Cel mai frecvent tip de lanț lateral la ciclizarea lanțului lateral este legarea disulfurii între reziduurile de cisteină. Această ciclizare este introdusă de o pereche de reziduuri de cisteină care sunt deprotate și apoi oxidate pentru a forma legături disulfură. Sinteza policiclică poate fi obținută prin eliminarea selectivă a grupurilor de protecție a sulfhidrilului. Ciclizarea se poate face fie într-un solvent post-disociere, fie într-o rășină pre-disociere. Ciclizarea rășinilor poate fi mai puțin eficientă decât ciclizarea solventului, deoarece peptidele de rășini nu formează cu ușurință conformații ciclificate. Un alt tip de ciclizare laterală a lanțului lateral este formarea unei structuri de amidă între un acid aspartic sau reziduul de acid glutamic și aminoacidul de bază, ceea ce necesită ca grupul de protecție laterală a lanțului să fie posibil să fie îndepărtat selectiv din polipeptidă, fie pe rășină, fie după disociere. Al treilea tip de ciclizare laterală a lanțului lateral este formarea eterelor difenilice prin tirozină sau p-hidroxifenilglicină. Acest tip de ciclizare în produsele naturale se găsește numai în produsele microbiene, iar produsele de ciclizare au adesea o valoare medicamentoasă potențială. Pregătirea acestor compuși necesită condiții de reacție unice, astfel încât acestea nu sunt adesea utilizate în sinteza peptidelor convenționale.

(2) Terminal-la-lateral
Ciclizarea lanțului lateral terminal implică de obicei terminalul C cu grupul amino al lanțului lateral al lizinei sau ornitinei sau al terminalului N cu acidul aspartic sau lanțul lateral al acidului glutamic. O altă ciclizare polipeptidă se face prin formarea legăturilor eterice între lanțurile laterale ale terminalului C și serină sau treonină.
(3) Tip terminal sau din cap la coadă
Polipeptidele în lanț pot fi fie ciclate într -un solvent, fie fixate pe o rășină în funcție de ciclarea lanțului lateral. Concentrații scăzute de peptide ar trebui utilizate în centralizarea solventului pentru a evita oligomerizarea peptidelor. Randamentul unui polipeptid cu inel sintetic din cap la coadă depinde de secvența polipeptidei în lanț. Prin urmare, înainte de prepararea peptidelor ciclice la scară largă, ar trebui creată mai întâi o bibliotecă de posibile peptide cu plumb înlănțuite, urmată de ciclizare pentru a găsi secvența cu cele mai bune rezultate.
2. N-metilare
N-metilarea apare inițial în peptide naturale și este introdusă în sinteza peptidelor pentru a preveni formarea legăturilor de hidrogen, făcând astfel peptidele mai rezistente la biodegradare și clearance. Sinteza peptidelor folosind derivate de aminoacizi N-metilate este cea mai importantă metodă. În plus, se poate folosi reacția Mitsunobu a intermediarilor de polipeptid-resin-nitrobenzen sulfonil) cu metanol. Această metodă a fost utilizată pentru prepararea bibliotecilor peptidice ciclice care conțin aminoacizi N-metilați.
3. Fosforilare
Fosforilarea este una dintre cele mai frecvente modificări post-translaționale în natură. În celulele umane, mai mult de 30% din proteine sunt fosforilate. Fosforilarea, în special fosforilarea reversibilă, joacă un rol important în controlul multor procese celulare, cum ar fi transducția semnalului, expresia genelor, ciclul celular și reglarea citoscheletului și apoptoza.
Fosforilarea poate fi observată la o varietate de reziduuri de aminoacizi, dar cele mai frecvente ținte de fosforilare sunt reziduurile de serină, treonină și tirozină. Fosfotirozina, fosfoteonina și derivații de fosfoserină pot fi introduse fie în peptide în timpul sintezei, fie formate după sinteza peptidelor. Fosforilarea selectivă poate fi obținută folosind reziduuri de serină, treonină și tirozină care elimină selectiv grupurile de protecție. Unii reactivi de fosforilare pot introduce, de asemenea, grupe de acid fosforic în polipeptid prin modificarea post. În ultimii ani, fosforilarea lizinei specifice site-ului a fost obținută folosind o reacție selectivă din punct de vedere chimic-Staudinger-fosfit (Figura 3).

4. Myristoylation și Palmitoylation
Acilarea terminalului N cu acizi grași permite peptidelor sau proteinelor să se lege de membranele celulare. Secvența miridamoylată de pe N-terminal permite proteinelor kinazelor familiei Src și a proteinelor GAQ transcriptază inversă să fie vizate pentru a se lega de membranele celulare. Acidul miristic a fost legat de terminalul N al rășinii-polipeptid folosind reacții de cuplare standard, iar lipopeptida rezultată ar putea fi disociată în condiții standard și purificată de RP-HPLC.
5. Glicozilare
Glicopeptidele precum vancomicina și teicolanina sunt antibiotice importante pentru tratamentul infecțiilor bacteriene rezistente la medicamente, iar alte glicopeptide sunt adesea utilizate pentru a stimula sistemul imunitar. În plus, din moment ce mulți antigeni microbieni sunt glicozilați, este de mare semnificație studierea glicopeptidelor pentru îmbunătățirea efectului terapeutic al infecției. Pe de altă parte, s -a constatat că proteinele de pe membrana celulară a celulelor tumorale prezintă o glicozilare anormală, ceea ce face ca glicopeptidele să joace un rol important în cercetarea cancerului și a apărării imunitare tumorale. Glicopeptidele sunt preparate prin metoda FMOC/T-BU. Reziduurile glicozilate, cum ar fi treonina și serina, sunt adesea introduse în polipeptide de către FMOC -uri activate de pentafluorofenol pentru a proteja aminoacizii glicozilați.
6. Isopren
Isopentadienilarea are loc pe reziduurile de cisteină în lanțul lateral în apropierea terminalului C. Izoprenul proteic poate îmbunătăți afinitatea membranei celulare și poate forma interacțiunea proteină-proteină. Proteinele izopentadienate includ tirozină fosfatază, gtase mici, molecule de cochaperonă, lamina nucleară și proteine de legare centromerică. Polipeptidele de izopren pot fi preparate folosind izopren pe rășini sau prin introducerea derivatelor de cisteină.
7. Modificare polietilen glicol (PEG)
Modificarea PEG poate fi utilizată pentru a îmbunătăți stabilitatea hidrolitică proteică, biodistribuția și solubilitatea peptidelor. Introducerea lanțurilor PEG în peptide poate îmbunătăți proprietățile farmacologice și, de asemenea, inhibă hidroliza peptidelor de către enzimele proteolitice. Peptidele PEG trec prin secțiunea transversală capilară glomerulară mai ușor decât peptidele obișnuite, reducând considerabil clearance -ul renal. Datorită timpului de înjumătățire activ al peptidelor PEG extinse in vivo, nivelul normal de tratament poate fi menținut cu doze mai mici și medicamente peptidice mai puțin frecvente. Cu toate acestea, modificarea PEG are și efecte negative. Cantități mari de PEG împiedică enzima să degradeze peptida și, de asemenea, reduc legarea peptidei la receptorul țintă. Dar afinitatea scăzută a peptidelor PEG este de obicei compensată de timpul lor de înjumătățire farmacocinetic mai lung, iar prin faptul că sunt prezenți în corp mai lung, peptidele PEG au o probabilitate mai mare de a fi absorbite în țesuturile țintă. Prin urmare, specificațiile polimerului PEG ar trebui să fie optimizate pentru rezultate optime. Pe de altă parte, peptidele PEG se acumulează în ficat din cauza unei eliberări renale reduse, rezultând sindrom macromolecular. Prin urmare, modificările PEG trebuie să fie proiectate mai atent atunci când sunt utilizate peptide pentru testarea medicamentelor.

Grupurile comune de modificare a modificatorilor PEG pot fi rezumate aproximativ după cum urmează: amino (-amină) -nh2, aminometil -CH2 -NH2, hidroxi -oh, carboxi -cooh, sulfhidril (-thiol) -sh, maleimide -mal, succinimide carbonat -SC, succinimide -acetat -ecin, succinimidă propine n-hydroxysuccinimide -NHS, Acrylate-ch2ch2cooh, aldehyde -CHO (such as propional-ald, butyrALD), acrylic base (-acrylate-acrl), azido-azide, biotinyl -Biotin, Fluorescein, glutaryl -GA, Acrylate Hydrazide, alkyne-alkyne, P -tolunesulfonat -OT -uri, succinimidă succinată -ss, etc. Derivații PEG cu acizi carboxilici pot fi cuplate la amine N -terminale sau lanțuri laterale lizinei. PEG amino activat poate fi cuplat cu acid aspartic sau lanțuri laterale de acid glutamic. PEG-ul activat mal poate fi conjugat cu mercaptan cu lanțuri laterale cisteine complet deprotejate [11]. Modificatorii PEG sunt clasificați în mod obișnuit după cum urmează (NOTĂ: MPEG este metoxi-PEG, CH3O- (CH2CH2O) N-CH2CH2-OH):
(1) Modificator de PEG cu lanț drept
MPEG-SC, MPEG-SCM, MPEG-SPA, MPEG-OTS, MPEG-SH, MPEG-ALD, MPEG-BUTYRALD, MPEG-SS
(2) Modificator PEG bifuncțional
HCOO-PEG-COOH, NH2-PEG-NH2, OH-PEG-COOH, OH-PEG-NH2, HCL · NH2-PEG-COOH, MAL-PEG-NHS
(3) Modificator de ramificare PEG
(MPEG) 2-NHS, (MPEG) 2-ALD, (MPEG) 2-NH2, (MPEG) 2-mal
8. Biotinizare
Biotina poate fi puternic legată cu avidină sau streptavidină, iar puterea de legare este chiar apropiată de legătura covalentă. Peptidele marcate cu biotină sunt utilizate în mod obișnuit în domeniul imuno-testului, histocitochimiei și citometriei cu flux pe bază de fluorescență. Anticorpii cu antibiotină marcate pot fi de asemenea folosiți pentru a lega peptidele biotinilate. Etichetele de biotină sunt adesea atașate la lanțul lateral al lizinei sau la terminalul N. Acidul 6-aminocaproic este adesea utilizat ca legătură între peptide și biotină. Legătura este flexibilă în legarea la substrat și se leagă mai bine în prezența unei piedici sterice.
9. Etichetare fluorescentă
Etichetarea fluorescentă poate fi utilizată pentru a urmări polipeptidele în celulele vii și pentru a studia enzimele și mecanismele de acțiune. Triptofanul (TRP) este fluorescent, deci poate fi utilizat pentru etichetarea intrinsecă. Spectrul de emisie al triptofanului depinde de mediul periferic și scade odată cu scăderea polarității solventului, o proprietate care este utilă pentru detectarea structurii peptidice și legarea receptorului. Fluorescența triptofanului poate fi stinsă de acid aspartic protonat și acid glutamic, ceea ce poate limita utilizarea acestuia. Grupa clorură de dansil (Dansil) este extrem de fluorescentă atunci când este legată de o grupare amino și este adesea utilizată ca etichetă fluorescentă pentru aminoacizi sau proteine.
Conversia de energie prin rezonanță fluorescentă (FRET) este utilă pentru studiile enzimatice. Când se aplică FRET, polipeptida substratului conține, de obicei, un grup de etichetare a fluorescenței și un grup de ridicare a fluorescenței. Grupurile fluorescente etichetate sunt stinse de stingere prin transfer de energie non-foton. Când peptida este disociată de enzima în cauză, grupul de etichetare emite fluorescență.
10. Polipeptide cu cușcă
Peptidele cuști au grupuri de protecție detașabile optic care protejează peptida de legarea la receptor. Când este expus la radiații UV, peptida este activată, restabilind afinitatea sa la receptor. Deoarece această activare optică poate fi controlată în funcție de timp, amplitudine sau locație, peptidele cuști pot fi utilizate pentru a studia reacțiile care apar în celule. Cele mai utilizate grupuri de protecție pentru polipeptidele cuști sunt grupele 2-nitrobenzil și derivații lor, care pot fi introduși în sinteza peptidelor prin derivați de aminoacizi protectori. Derivații de aminoacizi care au fost dezvoltați sunt lizina, cisteina, serina și tirozina. Cu toate acestea, derivații de aspartat și glutamat nu sunt folosiți în mod obișnuit datorită susceptibilității lor la ciclizare în timpul sintezei și disocierii peptidelor.
11. Peptidă polivologică (MAP)
Peptidele scurte nu sunt de obicei imune și trebuie cuplate la proteine purtătoare pentru a produce anticorpi. Peptida poliatigenică (MAP) este compusă din mai multe peptide identice conectate la nucleele de lizină, care pot exprima în mod specific imunogeni cu potență ridicată și pot fi utilizate pentru a prepara cuplete proteice peptidice. Polipeptidele MAP pot fi sintetizate prin sinteză în fază solidă pe rășina MAP. Cu toate acestea, cuplarea incompletă are ca rezultat lanțurile peptidice lipsă sau trunchiate pe unele ramuri și, prin urmare, nu prezintă proprietățile polipeptidei MAP originale. Ca alternativă, peptidele pot fi preparate și purificate separat și apoi cuplate la MAP. Secvența peptidă atașată la miezul peptidei este bine definită și ușor de caracterizat prin spectrometrie de masă.
Concluzie
Modificarea peptidelor este un mijloc important de proiectare a peptidelor. Peptidele modificate chimic nu pot menține doar o activitate biologică ridicată, dar, de asemenea, evită eficient dezavantajele imunogenității și toxicității. În același timp, modificarea chimică poate înzestra peptide cu câteva noi proprietăți excelente. În ultimii ani, metoda de activare C-H pentru post-modificarea polipeptidelor a fost dezvoltată rapid și au fost obținute multe rezultate importante.
Timpul post: 2025-07-03
