Transfer de energie prin rezonanță fluorescentă (FRET)
Transferul energiei prin rezonanță fluorescentă (FRET) este un proces de transfer de energie non-radiativ în care energia stării excitate donor este transferată în starea excitată acceptor prin interacțiunea cuplurilor electrice intermoleculare.Acest proces nu implică fotoni și, prin urmare, este non-radiativ.Acest test are avantajele de a fi rapid, sensibil și simplu.
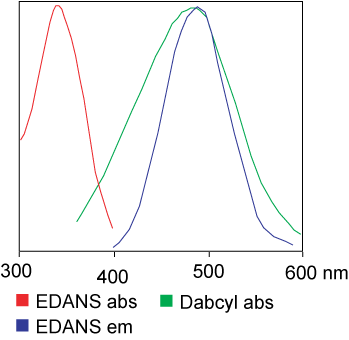
Colorantul utilizat în testul FRET poate fi identic.Dar, în majoritatea aplicațiilor, sunt utilizați de fapt diferiți coloranți.Pe scurt, transferul de energie de rezonanță luminoasă este transferul unei perechi de dipoli de la donor (colorantul 1) la acceptor (colorantul 2) atunci când grupul donor este excitat.În general, spectrul de emisie al grupului de fluorofor Donor se suprapune cu spectrul de absorbție al grupului Acceptor.„Când distanța dintre cei doi fluorofori este adecvată (10 — 100 A), se poate observa transferul energiei fluoroforului de la donor la acceptor.”Metoda de transfer de energie depinde de structura chimică a receptorului:
1. Este transformată în vibrație moleculară, adică lumina luminoasă a transferului de energie dispare.(Receptorul este un stingător de lumină)
2. Emisia este mai intensă decât receptorul în sine, rezultând o deplasare către roșu în spectrul de fluorescență secundar.”(Receptorii sunt emițători luminoși).
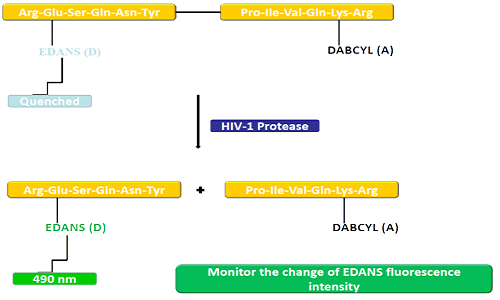
Grupul donor (EDANS) și gena acceptor (DABCYL) sunt legate uniform de substratul natural al proteazei HIV, iar atunci când substratul nu este deconectat, DABCYL poate stinge EDANS și apoi devine nedetectabil pentru fluor.La deconectarea proteazei HIV-1, EDANS nu mai este stins de DABCYL, iar luciferazele EDANS pot fi detectate ulterior.Disponibilitatea inhibitorilor de protează poate fi monitorizată prin modificări ale intensității fluorescenței EDANS.
Peptidele FRET sunt instrumente convenabile pentru a studia nespecificitatea peptidazei.Deoarece procesul său de reacție poate fi monitorizat continuu, oferă o metodă convenabilă pentru detectarea activității enzimatice.Strălucirea produsă după hidroliza legăturilor peptidice de către donor/acceptor oferă o măsură a activității enzimatice la concentrații nanomolare.Când peptida FRET este intactă, ea arată o dispariție bruscă a fulgerului intern, dar atunci când orice legătură peptidică opusă donorului/acceptorului se rupe, eliberează un fulger, care poate fi detectat continuu și apoi activitatea enzimatică poate fi cuantificată.
Ora postării: 14-aug-2023