Conform modului de conectare dintre aminoacid și zahăr, peptida zahărului poate fi împărțită în patru categorii: glicozilare O, glicozilare C a N, zaharificare de rouă și conexiune GPI (glicofosfatidlyinozitol).
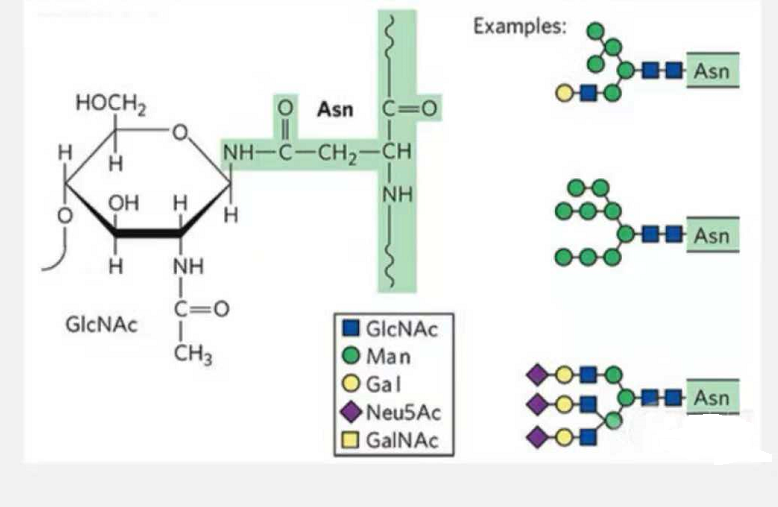
1. Glicopeptidele de N-glicozilare sunt compuse din N-acetamidă glucoză la capătul reducător al lanțului de glicani (Glc-Nac) legat de atomul de N din grupul amidic al lanțului lateral al unor Asn din lanțul peptidic și Asn. capabil de a lega lanțul de glican trebuie să fie localizat în AsN-X-Ser /Thr (X! =P) în motivul format de reziduuri.Zahărul este N-acetilglucozamină.
Glicopeptidă structurală modificată prin N-glicozilare
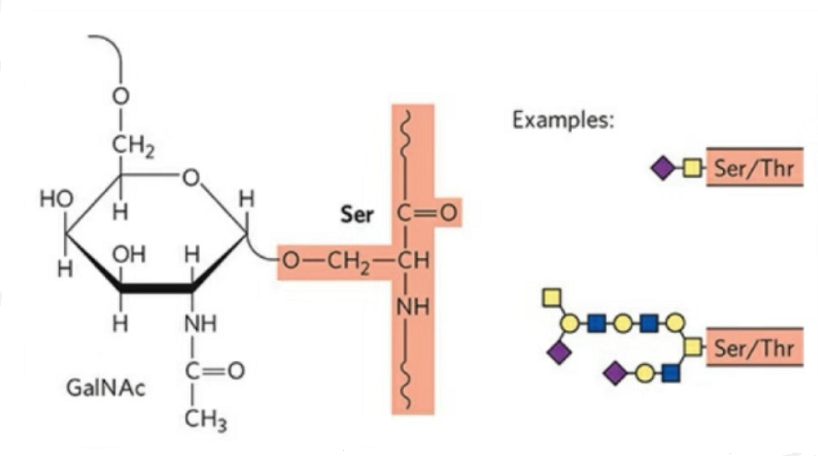
2. Structura O-glicozilării este mai simplă decât a N-glicozilării.Această glicopeptidă este în general mai scurtă decât glicanul, dar are mai multe tipuri decât N-glicozilarea.Ser şi Thr pot fi în general glicozilate în lanţul peptidic.În plus, există glicopeptide decorate cu glicozilare tirozină, hidroxil și hidroxiprolină.Poziția legăturii este atomul de oxigen hidroxil de pe lanțul lateral al reziduului.Zaharurile legate sunt galactoza sau N-acetilgalactozamina (Gal&GalNAc) sau glucoza/glucozamina (Glc/GlcNAc), manoza/manozamina (Man/ManNAc), etc.
O-glicozilarea modifică structura
3. Glicopeptidă O-GlcNAC glicozilare ((N-acetilcisteină (NAC)) (glcnAcN-acetilglucozamină/acetilglucozamină)
O singură glicozilare N-acetilglucozamină (GlcNAc) conectează proteinele O-GlcNAc la atomul de oxigen hidroxil al reziduului de serină sau treonină al unei proteine.Glicozilarea O-GlcNA este ornament monozaharidic O-GlcNAc fără extensie de glican;Ca și fosforilarea peptidelor, glicozilarea O-GlcNAc a glicopeptidelor este, de asemenea, un proces dinamic de decorare a proteinelor.Decorul anormal O-GlcNAc poate provoca o varietate de boli, cum ar fi diabet, boli cardiovasculare, tumori, boala Alzheimer și așa mai departe.
Punctele de glicozilare ale glicopeptidelor
Structurile de bază ale lanțurilor polipeptidice și de zahăr sunt legate de lanțurile de proteine prin legături covalente, iar situsurile care leagă lanțurile de zahăr sunt numite situsuri de glicozilare.Deoarece nu există un șablon care să urmărească biosinteza lanțurilor de zahăr glicopeptidice, diferite lanțuri de zahăr vor fi atașate la același loc de glicozilare, ceea ce duce la așa-numita neomogenitate microscopică.
Glicozilarea glicopeptidelor
1. Efectul glicozilării glicopeptidelor asupra eficacității terapiei a proteinelor terapeutice
În cazul proteinelor terapeutice, glicozilarea afectează, de asemenea, timpul de înjumătățire și țintirea medicamentelor proteice in vivo
2. Glicozilarea glicopeptidelor solubile și proteine
Studiile au arătat că lanțurile de zahăr de pe suprafața proteinelor pot îmbunătăți solubilitatea moleculară a proteinelor
3. Glicozilarea glicopeptidelor și imunogenitatea proteinelor
Pe de o parte, lanțurile de zahăr de pe suprafața proteinelor pot induce răspunsuri imune specifice.Pe de altă parte, lanțurile de zahăr pot acoperi anumite suprafețe de pe suprafața proteinei și pot reduce imunogenitatea acesteia
4. Glicozilarea glicopeptidelor care mărește stabilitatea proteinelor
Glicozilarea poate crește stabilitatea proteinelor la diferite condiții de denaturare (cum ar fi denaturanți, căldură etc.) și poate evita agregarea proteinelor.În același timp, lanțurile de zahăr de pe suprafața proteinelor pot acoperi și unele puncte de degradare proteolitică a moleculelor de proteine, crescând astfel rezistența proteinelor la proteinaze.
5. Glicozilarea glicopeptidelor care afectează activitatea biologică a moleculelor proteice
Modificarea glicozilării proteinelor poate permite, de asemenea, moleculelor de proteine să formeze noi activități biologice
Ora postării: Aug-03-2023